CAR-T细胞疗法研究进展(第42期)
来源:生物谷原创 2024-03-29 10:17
CAR-T细胞产品liso-cel可增加复发性大B细胞淋巴瘤患者的生存率、利用CAR-T细胞靶向表达内皮唾酸蛋白的非癌细胞有望治疗乳腺癌
CAR-T (Chimeric Antigen Receptor T-Cell Immunotherapy),即嵌合抗原受体T细胞免疫疗法。该疗法是一种出现了很多年但近几年才被改良,并使用到临床中的新型细胞疗法。在急性白血病和非霍奇金淋巴瘤的治疗上有着显著的疗效,被认为是最有前景的肿瘤治疗方式之一。正如所有的技术一样,CAR-T技术也经历一个漫长的演化过程,正是在这一系列的演化过程中,CAR-T技术逐渐走向成熟。
这种新的治疗策略的关键之处在于识别靶细胞的被称作嵌合抗原受体(chimeric antigen receptor, CAR)的人工受体,而且在经过基因修饰后,病人T细胞能够表达这种CAR。在人体临床试验中,科学家们通过一种类似透析的过程提取出病人体内的一些T细胞,然后在实验室对它们进行基因修饰,将编码这种CAR的基因导入,这样这些T细胞就能够表达这种新的受体。这些经过基因修饰的T细胞在实验室进行增殖,随后将它们灌注回病人体内。这些T细胞利用它们表达的CAR受体结合到靶细胞表面上的分子,而这种结合触发一种内部信号产生,接着这种内部信号如此强效地激活这些T细胞以至于它们快速地摧毁靶细胞。
近年来,CAR-T免疫疗法除了被用来治疗急性白血病和非霍奇金淋巴瘤之外,经改进后,也被用来治疗实体瘤、自身免疫疾病、HIV感染和心脏病等疾病,具有更广阔的应用空间。基于此,针对CAR-T 细胞疗法取得的最新进展,小编进行一番盘点!
1.Blood:CAR-T细胞产品liso-cel可增加复发性大B细胞淋巴瘤患者的生存率
doi:10.1182/blood.2023020854
之前发表在Lancet期刊上的一项临床试验(下称初始临床试验)已发现,一种嵌合抗原受体(CAR)T细胞(CAR-T)疗法——lisocabtagene maraleucel(liso-cel),对几乎所有复发性或难治性大B细胞淋巴瘤患者都具有很高的安全性(Lancet, 2020, doi:10.1016/S0140-6736(20)31366-0)。
如今,一项为期两年的随访临床试验(下称随访临床试验)发现,这种治疗复发性或难治性大B细胞淋巴瘤的新型个性化细胞疗法显示出很强的安全性,并提高了患者的总生存率。相关研究结果近期发表在Blood期刊上,论文标题为“Two-year follow-up of lisocabtagene maraleucel in relapsed or refractory large B-cell lymphoma in TRANSCEND NHL 001”。

在这项新的随访临床试验中,来自那项初始临床试验的所有269名患者此前平均接受过三线治疗,包括化疗和骨髓移植。两年后,患者的平均生存期为 27.3 个月,估计两年生存率为 50.5%。2%的患者出现了不良反应,特别是3至4级细胞因子释放综合征——机体产生的蛋白对CAR-T 细胞产生反应,导致发热和器官功能障碍,而且10%的患者出现了神经系统不良反应。
Gordon说,这些结果很有希望,但是他补充说,还需要进行更多的研究工作,以确保所有患者都能对这种疗法产生反应并减少毒性。Gordon说,“其中一个问题是,为什么不是百分之百有效?我们正在了解很多关于肿瘤遗传构成、肿瘤微环境、患者T细胞健康的知识,这些因素在决定治疗结果方面发挥了作用。”
2.JITC:利用CAR-T细胞靶向表达内皮唾酸蛋白的非癌细胞有望治疗乳腺癌
doi:10.1136/jitc-2023-008608
在一项新的研究中,来自英国伦敦癌症研究所、伯明翰大学、曼彻斯特大学和瑞士洛桑大学的研究人员发现,一种针对非癌细胞的新型免疫疗法可能有助于防止乳腺癌肿瘤的生长和扩散。这种靶向内皮唾酸蛋白(endosialin)的免疫疗法会破坏肿瘤的血液供应,从而阻碍肿瘤的生长和扩散。相关研究结果近期发表在Journal for ImmunoTherapy of Cancer期刊上,论文标题为“Targeting the activated microenvironment with endosialin (CD248)-directed CAR-T cells ablates perivascular cells to impair tumor growth and metastasis”。
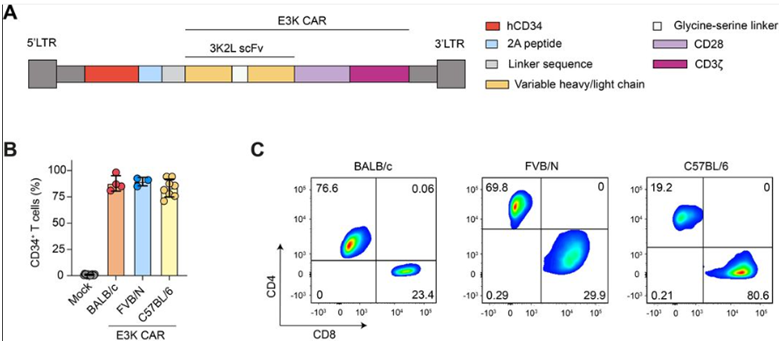
图片来自Journal for ImmunoTherapy of Cancer, 2024, doi:10.1136/jitc-2023-008608
CAR-T细胞疗法已被用于治疗某些血癌,科学家们正试图找到使它对其他类型癌症(包括乳腺癌)有效的方法。然而,CAR-T 细胞疗法并不总是对肿瘤有效,因为肿瘤微环境会抑制免疫反应,而且要找到乳腺癌细胞的特定特征进行靶向攻击也很困难。
为了应对这些挑战,这些作者利用CAR-T细胞靶向在肿瘤血液供应周围制造内皮唾酸蛋白的细胞,而不是真正的癌细胞。在小鼠实验中,靶向内皮唾酸蛋白成功地减少了乳腺癌的生长和扩散。他们还对小鼠的肺癌肿瘤进行了测试,并看到了类似的成功结果。这表明患有其他类型癌症的患者也可能从这种新疗法中受益。
此外,这些作者还发现,CAR-T细胞疗法不影响不表达内皮唾酸蛋白的细胞,这表明它可能作为一种癌症特异性疗法,对患者的副作用可能更小。他们目前正在进一步开发这种疗法,以便在临床试验中进行测试。
3.Nat Med:初步临床试验表明鞘内注射靶向EGFR和IL13Rα2的双靶点CAR-T细胞有望治疗复发性胶质母细胞瘤
doi:10.1038/s41591-024-02893-z
在一项新的研究中,来自美国宾夕法尼亚大学佩雷尔曼医学院的研究人员领导了一项正在进行的1期临床试验,首批六名接受靶向两种脑肿瘤相关蛋白的CAR-T 细胞疗法治疗的患者的早期结果显示这种细胞疗法有望减少复发性胶质母细胞瘤(GBM)(一种侵袭性脑癌)患者体内的实体瘤生长。
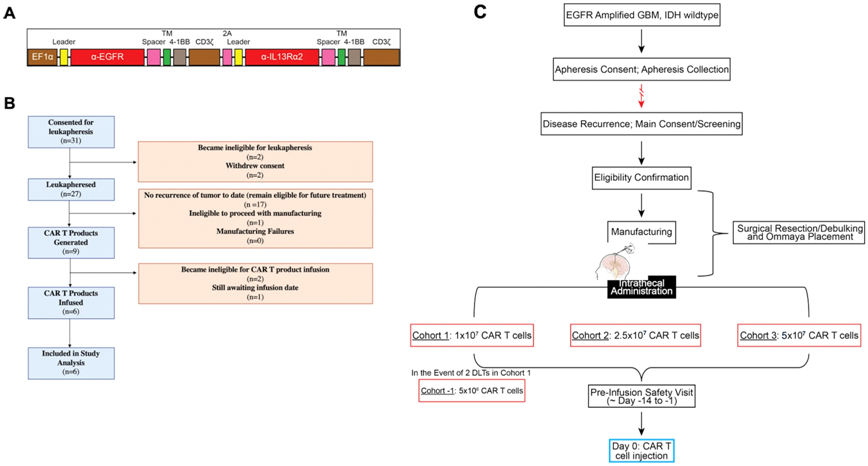
图片来自Nature Medicine, 2024, doi:10.1038/s41591-024-02893-z
这一发现表明这种“双靶点”方法在开发有效、持久的实体瘤(如GBM)疗法方面迈出了令人鼓舞的一步。相关研究结果于2024年3月13日在线发表在Nature Medicine期刊上,论文标题为“Intrathecal bivalent CAR T cells targeting EGFR and IL13Rα2 in recurrent glioblastoma: phase 1 trial interim results”
论文共同通讯作者、宾夕法尼亚大学佩雷尔曼医学院血液肿瘤学与神经外科助理教授Stephen Bagley博士说,“这是首次对胶质母细胞瘤患者给送靶向两种靶点而非一种的CAR-T细胞疗法。我们的研究结果表明,这是朝着正确方向迈出的一步,这种通过患者脊髓液给送的方法,可能是开发出能够战胜 GBM 复杂防御系统的疗法的关键。”
4.Nat Med:1期临床试验表明靶向IL13Rα2的CAR-T细胞有望治疗复发性高级别胶质瘤
doi:10.1038/s41591-024-02875-1
在一项新的研究中,来自美国希望之城的研究人员利用开创性CAR-T细胞疗法开展的一项I期临床试验显示该疗法对治疗无法治愈的脑瘤具有良好的临床活性。
该研究是迄今为止报道的最大的利用CAR-T细胞治疗实体肿瘤的临床试验,评估了靶向肿瘤相关抗原IL13Rα2(interleukin-13 receptor alpha 2)的CAR-T细胞,该产品由希望之城发明,并获得Mustang Bio Inc.独家授权。相关研究结果于2024年3月7日在线发表在Nature Medicine期刊上,论文标题为“Locoregional delivery of IL-13Rα2-targeting CAR-T cells in recurrent high-grade glioma: a phase 1 trial”
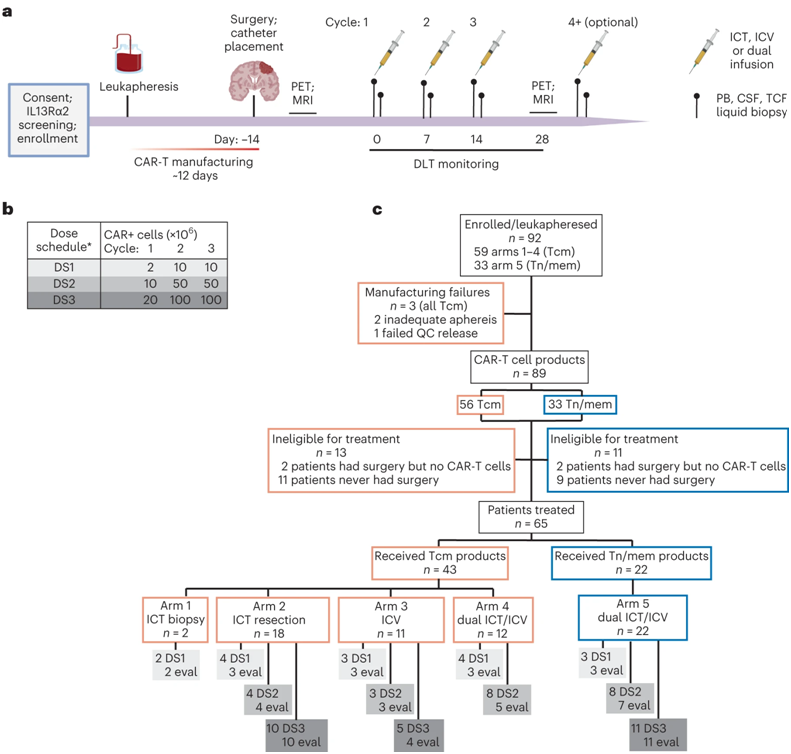
图片来自Nature Medicine, 2024, doi:10.1038/s41591-024-02875-1
在58名复发性高级别胶质瘤(主要是胶质母细胞瘤)患者中,有29人在接受CAR-T细胞治疗至少两个月后病情稳定。其中有两例部分应答、一例完全应答,在进行额外的CAR-T细胞治疗周期后,又有一例完全应答。该病例于2016年在New England Journal of Medicine期刊上进行了报道(NEJM, 2016, doi:10.1056/NEJMoa1610497)。
所有参与者都是在接受过手术、化疗或放疗或所有这些疗法治疗后复发的GBM患者,他们接受了靶向IL13Rα2的CAR-T细胞颅内注射,其中IL13Rα2在大多数胶质母细胞瘤中过度表达。随着这项临床试验的进展,治疗剂量不断增加,所有测试剂量的耐受性都很好。该临床试验评估了三种给送途径:直接注射到肿瘤部位、输注到脑脊液或同时注射到这两个部位。所有患者的中位总生存期为八个月。这项临床试验最终治疗了一组患者,这组患者使用了优化的生产工艺,在肿瘤部位和脑脊液中都注射了CAR-T 细胞。对于这个最终的患者队列,这些作者能够确定最大可行剂量,并发现这些患者的中位总生存期最好,为 10.2 个月,高于复发性胶质母细胞瘤患者 6 个月的预期生存期。
神经外科主任Behnam Badie博士说,“这些患者接受了大量的预处理,因此我们不确定他们在接受 CAR-T 细胞疗法后会有怎样的表现。然而,其中一些人的表现甚至比他们最初对标准护理治疗的反应还要好。”
5.Natl Sci Rev:浙大科学家利用模拟淋巴结的生物材料支架增强CAR-T细胞抵抗实体瘤的能力
doi:10.1093/nsr/nwae018
在一项新的研究中,中国浙江大学药学院的顾臻(Zhen Gu)博士、李洪军(Hongjun Li)博士和浙江大学医学院的孙杰(Jie Sun)博士及其团队旨在提高CAR-T细胞疗法对实体瘤的治疗效果。相关研究结果发表在2024年4月的National Science Review期刊上,论文标题为“Lymph node-biomimetic scaffold boosts CAR-T therapy against solid tumor”。
李博士说,“淋巴结是免疫系统的重要组成部分,负责 T 细胞的招募、安置和激活。我们设想,制造一种人工支架来模拟淋巴结的结构和功能,以便可以开发出一个‘细胞工厂’。这种设想中的细胞工厂在注射到肿瘤部位后,有可能显著促进支架内预装载的CAR-T细胞的原位激活和增殖。”
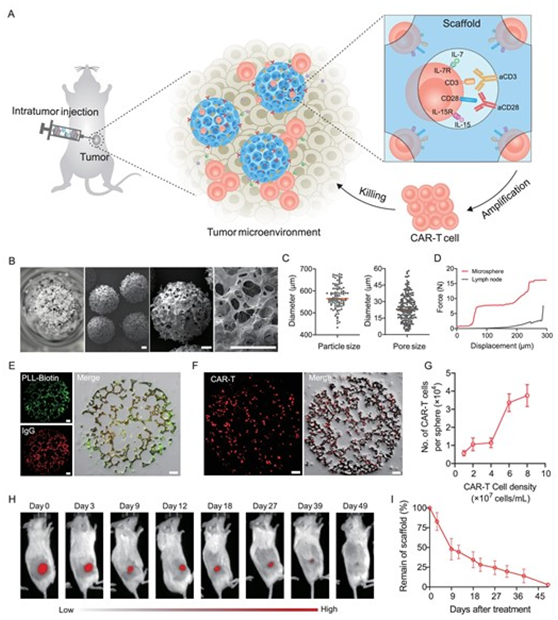
用于CAR-T细胞递送和增殖的支架的表征。图片来自National Science Review, 2024, doi:10.1093/nsr/nwae018
这些作者利用微流体技术,构建了一种基于聚乳酸-共聚乙醇酸(PLGA)的多孔微球支架。他们的评估显示,这种微球支架和它所含孔的平均直径分别为570微米和25微米,每个微球支架可容纳约38000个CAR-T细胞。
此外,这些作者还在这种多孔微球支架上装饰了两种T细胞活化的关键信号分子——抗CD3抗体和抗CD28抗体,进一步模拟淋巴结中的抗原递呈细胞。在评估CAR-T细胞增殖时,他们观察到该支架在体外诱导了50倍的显著增殖,在植入皮下肿瘤模型中诱导了15倍的增殖。
值得注意的是,受这种支架刺激的CAR-T细胞即使在增殖后仍能保持良好的杀伤活性。孙博士说,“这一点至关重要,因为CAR-T细胞在实体瘤内的活性下降是这种疗法面临的一个关键挑战。”他们在异种移植人类宫颈癌小鼠模型中展示了通过这种策略递送的 CAR-T 细胞表现出增强的抗肿瘤效果,这也证实了他们的发现。
6.EMBO Mol Med:开发出新方法来评估短期培养的 CAR-T 细胞的安全性
doi:10.1038/s44321-024-00055-9
在一项新的研究中,德国保罗-埃利赫研究院分子生物技术与基因治疗研究组组长Christian Buchholz教授领导的一个研究团队解决了与短期培养的CAR-T细胞有关的安全性问题。他们利用一种容易获得的小鼠模型和一种基于细胞的测试证实,与传统的CAR-T细胞相比,短期培养的CAR-T细胞诱发细胞因子释放综合征(CRS)的风险要高得多。相关研究结果于2024年3月21日发表在EMBO Molecular Medicine期刊上,论文标题为“Early induction of cytokine release syndrome by rapidly generated CAR T cells in preclinical models”。
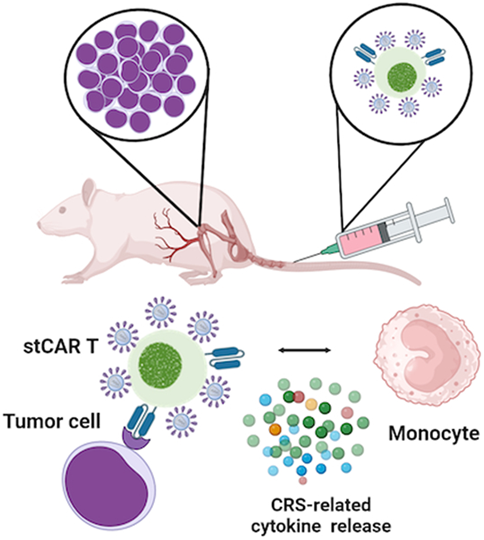
图片来自EMBO Molecular Medicine, 2024, doi:10.1038/s44321-024-00055-9
他们的研究还表明,CRS 相关细胞因子的释放与肿瘤细胞的存在无关。相反,经证实,短期培养的 CAR-T 细胞表面上的慢病毒载体颗粒残留成分是致病因素。
这些发现强调,在临床应用短期培养的 CAR-T 细胞后,需要特别关注 CRS 的诱发情况,同时在临床应用前也要有直接的测试系统对这些细胞进行风险评估。
7.EMBO Mol Med:新研究有望利用CAR-T 细胞疗法治疗TP53 基因发生突变的急性髓性白血病
doi:10.1038/s44321-024-00024-2
在一项新的研究中,来自瑞士苏黎世大学和苏黎世大学医院等研究机构的研究人员发现,一种侵袭性血癌的癌细胞中存在一种特殊突变,这种突变会阻碍 CAR-T 细胞疗法等新型免疫疗法发挥作用。他们的研究还解释了癌细胞产生抵抗性的原因,以及如何克服这种抵抗性:通过同时使用药物疗法或基因改良的 CAR-T细胞。相关研究结果发表在2024年3月14日的EMBO Molecular Medicine期刊上,论文标题为“Targeting the mevalonate or Wnt pathways to overcome CAR T-cell resistance in TP53-mutant AML cells”。
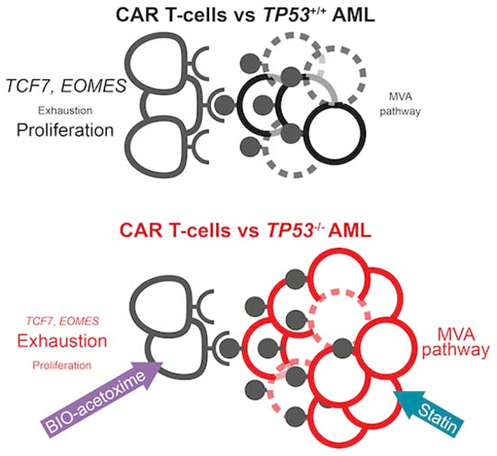
图片来自EMBO Molecular Medicine, 2024, doi:10.1038/s44321-024-00024-2
苏黎世大学和苏黎世大学医院肿瘤与血液科的 Markus Manz 教授和 Steffen Boettcher 教授领导的一个国际研究小组如今证实,携带TP53 突变的AML细胞对一种新型免疫疗法——CAR T 细胞疗法的抵抗力明显高于这个基因没有发生突变的AML细胞。Boettcher 说,“TP53 基因发生突变的 CAR-T 细胞效果较差的原因是,这些免疫细胞衰竭得更快,因此对癌细胞的活性较低。”
在 CAR-T 细胞疗法中,从患者血液中提取特定的免疫细胞,即T 细胞。然后在实验室中对这些免疫细胞进行基因改造,使其表面形成许多新的接触点,即嵌合抗原受体(CAR)。这些 CAR-T 细胞经重新输注回患者体内后,能够识别肿瘤细胞的某些表面结构,从而使得CAR-T 细胞能够识别癌细胞并有针对性地消灭它们。目前,多种 CAR-T 细胞产品正在早期临床试验中接受抗 AML 测试。
8.Blood:第二原发恶性肿瘤在CAR-T细胞治疗后的不良事件中所占比例很小
doi:10.1182/blood.2024024166
根据2024年3月14日发表在Blood期刊上的一篇标题为“Second Primary Malignancies After Commercial CAR T Cell Therapy: Analysis of FDA Adverse Events Reporting System (FAERS)”的letter类型文章,接受嵌合抗原受体(CAR)T细胞(CAR-T细胞)疗法的患者报告的不良事件(adverse event)中,第二原发恶性肿瘤(second primary malignancies, SPMs)只占一小部分。
美国哈佛医学院的Magdi Elsallab医学博士及其同事们分析了美国食品药品管理局(FDA)的不良事件报告系统数据库,以定量确定接受CAR-T细胞疗法治疗后报告的SPMs。
这些作者发现了12394份独特的与CAR-T细胞疗法相关的不良事件报告,其中2225份与系统器官类别“良性、恶性和未明确的肿瘤”有关。在应用排除标准后,共有 536 份SPMs报告(4.3%)被纳入其中。大多数报告都涉及CAR-T细胞疗法axicabtagene ciloleucel和tisagenlecleucel(分别占 51.7% 和 33.0%)。按高级组术语划分,最常见的 SPM 是白血病(62.1%),占所有 CAR-T 细胞疗法报告的 2.7%,其次是皮肤肿瘤(10.1%)。白血病包括骨髓增生异常综合征、急性髓性白血病和T细胞大颗粒淋巴细胞白血病(分别为208例、106例和2例)。
Elsallab在一份声明中说,“我们将继续关注FDA公布的数据,以了解更多有关 CAR-T 细胞疗法相关风险的信息。不过,必须强调的是,对于已批准的适应症,CAR-T 细胞疗法的益处仍然大于风险。”
9.Blood Adv:磁共振成像和腰椎穿刺可能并不是管理CAR-T细胞疗法相关神经毒性所必需的
doi:10.1182/bloodadvances.2023011669
根据一项新的研究,磁共振成像(MRI)和腰椎穿刺(lumbar puncture, LP)可能并不总是诊断和管理与CAR-T细胞疗法相关的严重神经系统并发症所必需的。这一研究结果进一步验证了脑电图(EEG)—— 一种测量大脑电活动的无创检测方法,在管理这种神经毒性方面的应用。相关研究结果于2024年3月19日发表在Blood Advances期刊上,论文标题为“Impact of diagnostic investigations in the management of CAR T-cell-associated neurotoxicity”。
论文通讯作者、法国雷恩大学医院血液学专家Guillaume Manson博士解释说,“在治疗CAR-T细胞相关毒性的患者时,我们通常会遵循基于1期和2期临床研究的非常严格的指导原则,然而几乎没有临床证据来验证这些指导原则。其中一些测试,如腰椎穿刺,可能会给患者带来极大的负担和创伤。在这里,我们希望更好地了解何时有必要进行这些干预,何时可以不进行这些干预。”
10.Molecular Cancer: 科学家揭示了一种更加优化的CAR-T细胞的生产模式
doi:10.1186/s12943-024-01938-8
嵌合抗原受体-T(CAR-T)细胞治疗是一种新的免疫治疗方法,在临床上取得了显著的成功。然而,由于准备时间长、成本高以及人与人之间的差异,它们的应用受到了限制。尽管通用CAR-T(U-CAR-T)细胞的制造有了明显的改善,但它们仍然不是一个稳定和统一的细胞库。
近日,来自中山大学中山医学院人体病毒学研究所的研究者们在Molecular Cancer杂志上发表了题为“The construction of modular universal chimeric antigen receptor T (MU-CAR-T)cells by covalent linkage of allogeneic T cells and various antibody fragments”的文章,该研究揭示了同种异体T细胞与多种抗体片段共价连接构建模块化通用嵌合抗原受体T细胞。
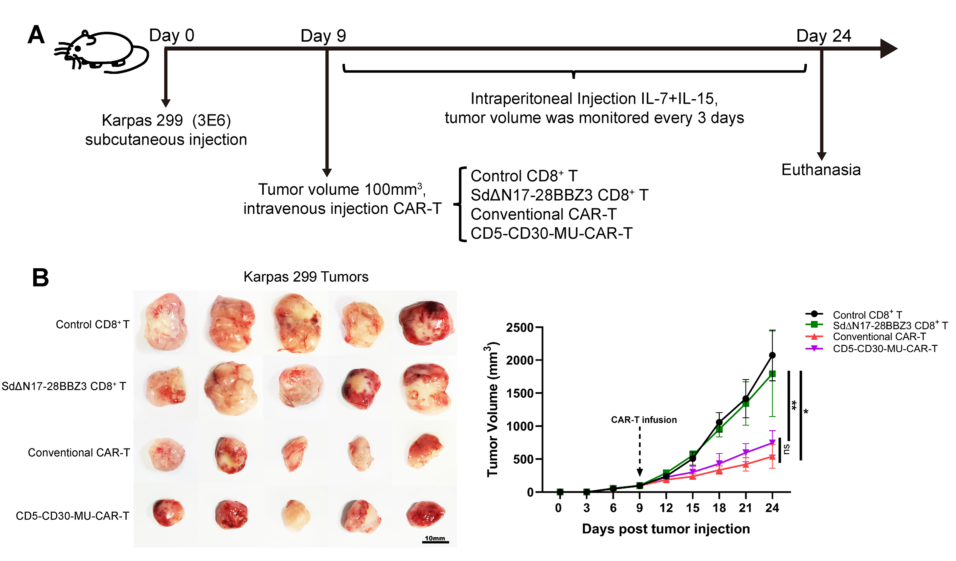
MU-CAR-T细胞在荷瘤小鼠体内的作用。图片来源:https://doi.org/10.1186/s12943-024-01938-8
在本研究中,研究者试图通过构建新型的模块化通用CAR-T(MU-CAR-T)细胞来进一步提高U-CAR-T细胞的便利性和灵活性。为此,研究者初步筛选了健康供者并培养了他们的T细胞,以获得更高比例的干细胞样记忆T细胞(TSCM),这些细胞具有强大的自我更新能力、可持续性和细胞毒性。
为了降低同种异体反应,利用CRISPR/Cas9系统对T细胞受体(TCR)和人类白细胞抗原-I类(HLAI)基因进行了双重敲除,进一步编辑了T细胞。然后,生长良好、遗传稳定的通用细胞被存储为稳定和统一的细胞库。随后,利用SDCatcher/GVoptiTag系统产生异肽键,将纯化的针对不同抗原的单链抗体与回收的CAR-T细胞共价连接。
由此产生的CAR-T细胞可以通过靶向不同的细胞来执行不同的功能,例如根除人类免疫缺陷病毒1型(HIV-1)潜伏感染的细胞或消除T淋巴瘤细胞,其效率与传统CAR-T细胞相似。
11.NEJM:1期临床试验表明下一代CAR-T细胞疗法有望治疗复发性胶质母细胞瘤
doi:10.1056/NEJMoa2314390
一个旨在为患有一种致命脑癌的患者带来细胞疗法的合作项目在首批接受这种新型疗法的患者中取得了显著效果。在一篇于2024年3月13日在线发表在New England Journal of Medicine期刊上的标题为“Intraventricular CARv3-TEAM-E T Cells in Recurrent Glioblastoma”的论文中,来自麻省总医院癌症中心的研究人员分享了一项评估参与利用治疗胶质母细胞瘤(GBM)的CAR-T细胞疗法开展的1期临床试验的首批三例患者的结果。
这项名为 INCIPIENT 的临床试验旨在评估 CARv3-TEAM-E T 细胞在复发性GBM患者中的安全性。单次治疗仅几天后,患者的肿瘤就出现了显著缩小,其中一名患者的肿瘤几乎完全消退。随着时间的推移,这些作者观察到这些患者的肿瘤出现了进展,但鉴于该策略取得了令人鼓舞的初步结果,他们将采取多种延长反应持久性的策略。
麻省总医院癌症中心和神经外科脑肿瘤免疫学和免疫疗法中心、细胞免疫疗法项目副主任、神经外科医生、医学博士 Bryan Choi 说,“这是一个从实验室到临床的治疗故事,麻省总医院实验室设计了一种新型细胞疗法,并在五年内将其应用于患者,满足了患者的迫切需求。CAR-T细胞疗法平台彻底改变了我们治疗癌症患者的思维方式,但像GBM这样的实体瘤仍然难以治疗,因为并非所有的癌细胞都完全相同,肿瘤内的细胞也各不相同。我们的方法结合了两种治疗形式,使我们能够以更广泛、更有效的方式治疗GBM。”
12.Cancer Cell:CAR-T细胞与抑制性药物的组合或有望治疗高风险的神经母细胞瘤患者
doi:10.1016/j.ccell.2023.11.004
嵌合抗原受体(CAR)T细胞疗法是抵御癌症的一种强大的武器,其能改变患者机体的T细胞以便其能更好地寻找并摧毁肿瘤细胞,但CAR-T细胞疗法并不是对于每一种癌症都有效,包括许多神经母细胞瘤,这种癌症开始于幼儿机体的神经组织,其会转移到机体的多个区域。
神经母细胞瘤可能是致命性的,患有高危神经母细胞瘤儿童的5年生存率仅有50%,近日,一篇发表在国际杂志Cancer Cell上题为“ALK inhibitors increase ALK expression and sensitize neuroblastoma cells to ALK.CAR-T cells”的研究报告中,来自哈佛医学院等机构的科学家们通过研究报告了一种新方法或能促使CAR-T细胞疗法能更好地治疗神经母细胞瘤,他们希望这一方法能尽快在高风险儿童中进行测试。
此前研究人员开发出了能特异性靶向作用ALK受体的CAR-T细胞,ALK受体是一种已知的能驱动很多癌症发生的癌基因,然而,并不是每个神经母细胞瘤患者机体的肿瘤细胞中都有足够水平的ALK受体能吸引强大的CAR-T细胞攻击。研究者Elisa Bergaggio博士表示,我们尝试在CAR-T细胞疗法中添加了一种ALK抑制剂药物,结果发现,这种抑制剂不仅能沉默ALK受体的致癌信号,还能增加细胞表面这些受体的数量,从而就能在ALK低水平表达的患者中为CAR-T细胞呈递更多的靶点。
ALK受体存在,但却会被ALK抑制剂所失活,而且因为其并不活跃,并且会停留在细胞表面,这种增加的表面表达就会促进CAR-T细胞的结合和杀灭活性。正如研究人员在文章中报道的那样,靶向ALK的CAR-T细胞和ALK抑制剂的组合或能作为一种治疗转移性神经母细胞瘤小鼠的潜在疗法,接受这种组合性疗法的小鼠机体的肿瘤生长会明显减少且生存率会提高。
目前研究人员正在致力于开发一种增强型更有效的2.0版本疗法,与此同时他们也向FDA申请批准在难治性或复发性神经母细胞瘤患儿中开展这种组合性疗法的测试工作,相关临床试验有望在今年春天开始进行。复发性或难治性神经母细胞瘤患儿首先将接受递增剂量的ALK靶向性CAR-T细胞进行单独治疗,如果被证明是安全的,随后还会再增加ALK抑制剂进行治疗,针对每个患者的CAR-T细胞都会在研究人员所在的实验室的基因疗法设施中进行制造。(生物谷Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


